Dr. Guillermo Flores Flores
El sistema nervioso central es uno de los tejidos más ricos en elementos celulares, en particular debido a su alta especialización. En términos generales encontramos dos grupos cellares principales, el tejido neuronal, el tejido de sostén principalmente ocupado por el tejido glial. Dentro de las cellas gliales tenemos a los astrocitos, que son un tipo de célula glial que se localiza en el sistema nervioso central, esto es, en el encéfalo y en la médula espinal. Como el resto de la glía, los astrocitos cumplen roles de soporte en relación a las neuronas, las principales células del sistema nervioso desde un punto de vista funcional. Estas células gliales tienen una forma que recuerda ligeramente a la de una estrella; su nombre se deriva de este hecho, puesto que las palabras griegas y latinas “astron” y “astrum” se traducen como “estrella” o “cuerpo celeste”. Tal estructura se debe a que tienen muchas prolongaciones (“pies”) que conectan el soma con otras células cercanas. Los astrocitos se forman en la vida embrionaria a partir de células del ectodermo, la capa del disco embrionario de las que surgen el sistema nervioso y la epidermis, durante el desarrollo temprano del organismo. Como la mayor parte de la glía, los astrocitos parten de células indiferenciadas similares a las que dan lugar a las neuronas. Como sabemos, las neuronas se especializan en la transmisión de impulsos nerviosos. Por ello resultan muy eficaces en esta tarea, pero necesitan el apoyo de otros tipos de célula para que el sistema nervioso pueda funcionar correctamente; es aquí donde interviene la glía o neuroglia, es decir, el conjunto de las células gliales, que supone el 50% de la masa nerviosa. Las funciones específicas de estas células dependen del tipo de glía al que nos refiramos. A modo general podemos decir que sirven principalmente para dar soporte físico y estructural a las neuronas, para aislar unas de otras, para proveerlas de nutrientes y oxígeno y para eliminar productos de deshecho y agentes patógenos. Otras células gliales especialmente relevantes son la microglía, que cumple funciones defensivas e inmunológicas en el encéfalo y la médula espinal, los oligodendrocitos y las células de Schwann, que forman las vainas de mielina que rodean a los axones y aceleran la transmisión neuronal en el sistema nervioso central y en el periférico, respectivamente. Durante mucho tiempo se creyó que la función de los astrocitos era básicamente estructural: “llenar los huecos” dejados por las neuronas en el sistema nervioso. Sin embargo, las investigaciones de las últimas décadas han demostrado que su papel, como el del resto de células gliales, es mucho más complejo. Los astrocitos y la glía en general cumplen el importante papel de proporcionar soporte físico a las neuronas, de modo que se mantengan en el lugar en el que se encuentran, además de regular la transmisión de impulsos eléctricos. Los astrocitos son la glía más abundante en el cerebro, de forma que su papel estructural tiene especial relevancia en este órgano.Estas células gliales actúan como intermediarios entre las neuronas y el sistema circulatorio, concretamente los vasos sanguíneos. En este sentido cumplen una función de filtrado, de modo que constituyen una parte de la barrera hematoencefálica, formada por células endoteliales cerebrales estrechamente unidas. Desde luego la conexión de los astrocitos con el sistema vascular permite que obtengan nutrientes, como la glucosa o el ácido láctico, de la sangre y puedan proporcionárselos a las neuronas.De modo similar, los astrocitos recogen los productos de deshecho de las neuronas y los transportan a la sangre para que puedan ser eliminados. Además, cuando se produce una lesión en el sistema nervioso los astrocitos se desplazan hacia ésta para fagocitar o eliminar las neuronas muertas, formando cicatrices en el área dañada al acumularse en ésta. Es posible que la astroglía tenga también la función de almacenar glucógeno, que sirve como depósito energético, con el objetivo de que las neuronas puedan acceder a estas reservas en momentos de necesidad. Los astrocitos ayudan a mantener el equilibrio iónico en el espacio extracelular; en concreto, revierten la acumulación excesiva de potasio porque son muy permeables a estas moléculas.
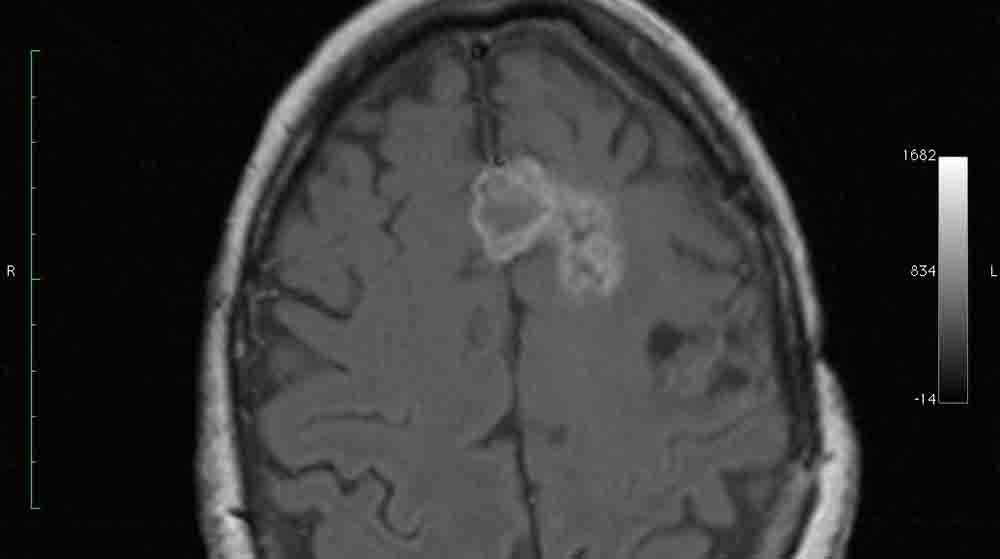
Existen tres tipos de astrocito que se diferencian por el linaje celular del que provienen, es decir, del tipo de células neuroepiteliales a partir del cual se originan. Así, podemos distinguir entre astrocitos fibrosos, protoplasmáticos y radiales.Estos astrocitos se localizan en la sustancia blanca del sistema nervioso, es decir, en las zonas formadas predominantemente por axones mielinizados. Se caracterizan por su bajo número de orgánulos (subunidades celulares con funciones diferenciadas).Los protoplasmáticos contienen muchos orgánulos y son el tipo de astrocito más numeroso. Se sitúan sobre todo en la sustancia gris del cerebro, compuesta principalmente por cuerpos celulares. La glía radial juega un papel determinante durante el proceso de migración celular, ya que las neuronas “viajan” por el sistema nervioso apoyándose en este tipo de astrocitos. No obstante, también hay células gliales radiales activas en la edad adulta, como las células de Bergman localizadas en el cerebelo. Los astrocitomas difusos (AD) son los gliomas de bajo grado más frecuentes. Afectan sobre todo a niños y adultos jóvenes entre 20 y 40 años. Se clasifican como tumores de grado II de la OMS. Se describen 3 subtipos histológicos: astrocitoma fibrilar, protoplásmico y gemistocítico. Las anomalías genéticas más frecuentes son las mutaciones de TP53 y del isocitrato deshidrogenasa 1 (IDH1). Aunque habitualmente se describen como tumores indolentes o “benignos”, los AD son en realidad neoplasias malignas que limitan la tasa de supervivencia a 10 años a un 17%, siendo la mediana de supervivencia de 4,7 años. Se han descrito múltiples variables pronósticas, entre las que destacan la edad y situación funcional del paciente, la existencia de déficit neurológico, el tamaño del tumor, y su localización en áreas elocuentes. Su síntoma de presentación más frecuente son las crisis epilépticas. Se presentan generalmente como lesiones difusas infiltrativas de localización hemisférica en sustancia blanca, pero pueden aparecer como lesiones focales circunscritas. Pueden afectar al córtex adyacente, y tienen especial predilección por áreas funcionales “secundarias” como el área suplementaria motora y el lóbulo de la ínsula. La captación de contraste es poco frecuente, y su aparición debe hacer sospechar mielinización. Los astrocitomas difusos (AD) son los gliomas de bajo grado más frecuentes clasificados como gliomas grado II de la OMS (Louis et al; 2007), afectan sobre todo a niños y adultos jóvenes entre 20 y 40 años, aunque en estudios recientes se ha observado un aumento progresivo de su incidencia en pacientes mayores de 60 años El síntoma de presentación más frecuente son las crisis epilépticas (65-95%), aunque, dado que se trata de tumores de crecimiento lento, con frecuencia los síntomas aparecen de forma insidiosa en forma de cefaleas (40%), cambios de conducta (10%), depresión, etc., y pueden prolongarse varios años antes del diagnóstico. Los Astrocitomas Difusos se presentan generalmente como lesiones difusas infiltrativas, pero pueden aparecer como lesiones focales circunscritas. Son tumores de localización hemisférica en sustancia blanca que pueden afectar al córtex adyacente, y que tienen especial predilección por áreas funcionales “secundarias” como el área suplementaria motora y el lóbulo de la ínsula (Ruiz et al; 2010). En RM son lesiones iso o hipointensas en T1, homogéneamente hiperintensas en T2, en las que la aparición de edema, hemorragia y captación de contraste son poco frecuentes [Astrocitoma difuso.jpg].
Se pueden observar calcificaciones en Tomografía Computarizada en el 15-20% de los casos. Puede afectar al córtex y producir erosión del díploe, indicando un crecimiento lento. En su extensión por los tractos de sustancia blanca puede condicionar crecimiento del hemisferio afecto, pasando a ser una forma de gliomatosis cerebri secundaria. Puede ser indistinguible de una lesión de sustancia blanca no neoplásica. En aquellos casos en los que aparezcan focos de captación de contraste o de restricción de difusión se debe sospechar una degeneración maligna.
En la clasificación histopatológica de la OMS actualizada en 2007 se diferencian 3 subtipos histológicos: – Astrocitoma fibrilar: Se observan fundamentalmente en los hemisferios cerebrales. Son tumores sólidos, pero pueden tener degeneración microquística. Habitualmente son hipercelulares y presentan atipia nuclear. Infiltran la sustancia blanca y pueden producir satelitosis cuando los astrocitos rodean a las neuronas [Histopatología astrocitoma fibrilar.
– Astrocitoma protoplásmico: Son tumores de la corteza cerebral, preferentemente frontotemporales. Presentan degeneración quística y degeneración mucoide. – Astrocitoma gemistocítico: Presentan astrocitos gemistocíticos en más de un 20%. Éstos tienen un aspecto hinchado, con citoplasma eosinófilo. Suele haber linfocitos perivasculares. Son los que con mayor frecuencia progresan hacia astrocitomas de alto grado.
Entre las características moleculares de los Astrocitomas Difusos la anomalía genética más común es la alteración de TP53 (> 59%). Como resultado de la interrupción de la cascada de las vías de transducción de señales y proliferación celular, la división celular anormal facilita la inestabilidad genómica y la transformación anaplásica. Es importante resaltar también el reciente hallazgo de la presencia de mutaciones del isocitrato deshidrogenasa entre el 59 y el 90% de los AD, mutación descrita como evento temprano en la tumorogénesis.
Aunque habitualmente se describen como tumores indolentes o “benignos”, los AD son neoplasias malignas que limitan la tasa de supervivencia a 10 años a un 17%, siendo la mediana de supervivencia de 4,7 años.
Se han descrito múltiples variables pronósticas en pacientes con gliomas de bajo grado. Lote et al. (Lote et al; 1997) publicaron un análisis retrospectivo univariante de 373 pacientes con diagnóstico de glioma de bajo grado en el que identificaron como factores pronósticos positivos una edad <20 años, un buen performance status (PS), la ausencia de déficit neurológicos y la ausencia de captación de contraste en estudios de imagen, aunque estudios prospectivos no han confirmado la importancia pronóstica de este último factor). A fin de conseguir datos más robustos, la European Organization for Research and Treatment of Cancer (EORTC) analizó de forma conjunta las bases de datos de dos ensayos clínicos (22844/22845). Los pacientes con astrocitomas pilocíticos fueron excluidos. El análisis multivariante mostró que la edad ? 40 años, la histología de astrocitoma, el diámetro máximo del tumor ? 6 cm, los tumores que cruzan la línea media y la presencia de déficit neurológico antes de la cirugía eran factores desfavorables para la supervivencia. Con estos datos establecieron un modelo pronóstico según el cual, las curvas de supervivencia global se separaban de acuerdo con el número de factores desfavorables presentes en cada paciente. Al agrupar los pacientes en dos grandes grupos, de bajo y alto riesgo, las medianas de SG resultantes en el grupo de validación fueron 7,8 y 3,67 años, respectivamente. Más recientemente, una revisión retrospectiva de 281 pacientes con glioma de bajo grado identificó factores asociados con una menor supervivencia: localización tumoral en área elocuente, KPS?80, edad >50 años y diámetro tumoral > 4 cm (Chang EF et al; 2008). Este último es el primer sistema pronóstico que considera la localización tumoral en un área elocuente como factor independiente de mal pronóstico.